초음파-연조직치료
초음파에 의한 세포 연조직 수복 및 치유
염증과 복원 과정은 이 분야에서 증가하는 지식의 관점에서 기술하기에 더 이상 단순한 내용이아니다.
본 리뷰는 전형적인 '상처' 접근 보다는 연부조직에 중점을 두고, 조직 복원과 관련된 핵심적인 반응의 간략한 요약본이다.
창상 치유(궤양, 욕창 등)에 대한 전기 자극 양식은 다른 문헌에서 다루었다(Watson,2008).
조직수복단계 및 기간
-
조직 치유(또는 조직 복원)은 살아있는 조직으로 파괴된 조직을 대체하는 것을 말하며(Walter and Israel1987), 재생 및 복원의 2가지 필수 요소로 구성된다.
둘 사이의 차이는 결과적 조직에 근거한다.
재생에서는, 특수화된 조직이 주변 손상되지 않은 특수화된세포의 증식에 의해 대체된다.
복원에서는, 손실된 조직이 반흔 조직을 형성하도록 성숙되는 육아조직에의해 대체된다.
본 리뷰는 복원 과정과 관련된 반응및 과정에 초점을 맞추었다.
미래의 어느 시점에서 이 영역에서 우세하게 될 줄기세포 치료에 대한 잠재력은 임상적으로 선호되는 손상 조직의 재생 가능성을 높여주지만, 아직 이 치료옵션은 주로 실험실 기반 또는 기껏해야 임상에서 실험적으로 남아있다.
치유 과정(복원)을 기술하는데 아마도 가장 간단한 방법은 서로 배타적이지 않고 중복되지 않는넓은 단계로 나누는 것이다.
전체 과정을 구분하는 여러 다른 방법이 있지만, 통상 4 단계로 나누며 여기에서 사용될 것이다
– 출혈, 염증, 증식 및 리 모델링.
기존의 출판된 문헌(Walter and Israel, 1987; Hardy, 1989; Peacock, 1984)에 추가하여, 일부최근 상세한 문헌은 Serhan et al, 2010; Granger and Senchenkova, 2010; Pitzer, 2006; Broughton et al, 2006에서 찾아볼 수 있다.
본 논문에서 주요한 정보는 Watson, 2003; 2006에서 이전에 출판되었다.
각 단계의 개요

-
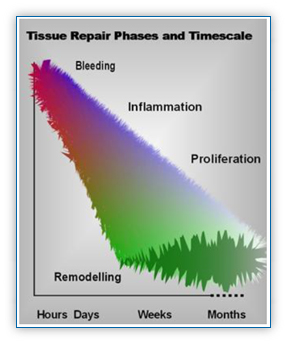
각 단계의 간단한 개요는 상세하게 기술하기 전에 여기에서 제시된다. Figure 1은 단계를 전반적인 정리한 것이다.
Figure 1(아래)는 조직 복원 과정의 주요 단계의 전체적인 모식도이다.
각 단계가 개별적인 독립체로써 보여지지만, 실제로는 한 단계가 다음 단계에 대한 자극제 또는 개시제로써의 역할을 하는 매우 계획적인 방식으로 상호 연결된다.
2-1. 출혈단계 (BLEEDING PHASE) 이는 상대적으로 짧은 주기의 단계이며, 상해, 외상 또는 기타 유사한 손상 후에 발생할 것이다.
분명하게 명백한 상해가 없었다면, 이는 거의 중요하지 않을 것이지만, 추가적인 연부조직 상해로 일부 출혈이 있을 것이다.
지혈까지의 정상 시간은 상해의 특성과 문제의 조직의 특성에 따라 달라질 것이다.
혈관이 좀 더 많은 조직(예, 근육)은 더 길게 출혈될 것이고 조직 내로 혈액의 더 많이 유출될 것이다.
다른 조직(예, 인대)은 덜 출혈이 일어날 것이다(기간 및 양에 대하여).
일반적으로 상해와 출혈 종료 사이의 간격은 약 몇 시간(4-6시간이 자주 인용됨)으로 알려져 있지만, 이는 평균 환자에서 평균 상해 후의 평균 기간이다.
비록 유의하게 낮은 비율이지만, 일부 조직은 유의하게 더 긴 시간 동안 출혈이 지속될 수 있다.
2-2. 염증단계 (INFLAMMATORY PHASE) 염증 단계는 조직 수복 과정에서 필수적인 요소이며, 상해에 대한 '부적절한 반응'으로써 보다 필요한 반응으로 간주된다.
물론 염증 과정의 수많은 다른 개시제들(예, 반복되는 사소한 외상, 기계적 자극)이 있지만, 본 논문의 목적에서는, 상해 모델이 채택될 것이다.
염증 단계는 빠른 개시(최대 몇 시간)를 갖으며, 점차적으로 해결(수주 이상)되기 전에 최대 반응(1-3일)으로 신속하게 증가한다. 염증은 여러 결과(아래 참조)를 나타낼 수 있지만, 조직 수복의 측면에서 이는 정상적이고 필수적이다.
개시와 해결은 혈관이 더 많은 조직에서 좀 더 신속하고, 상대적으로 혈관이 적은 조직에서는 더 느리다. 염증 반응의 다른 개시제는 기계적 자극, 반복된 사소한 외상, 과도한 열 및 냉각, 감염 및 다양한 자가면역 질환이 포함된다.
염증 반응은 어느 개시 경로이던지 본질적으로 같다.
2-3. 증식단계 (PROLIFERATION PHASE) 증식 단계는 본질적으로 수복 재료의 발생과 관련과 관련되어 있으며, 근골격계 상해의 대부분의 경우, 반흔(콜라겐) 물질(재료)의 합성을 수반한다.
증식 단계는 빠른 개시(24-48시간)을 갖지만, 최대 반응에 이르기까지 보통 상해 후 2-3주의 상당히 긴 시간이 소요된다(혈관이 많은 조직에서는 최대 증식 생산에 이르는 시간이 더 짧다).
이 최대 활성은 반흔 형성(수복)이 완료되는 시기를 나타내는 것이 아니고, 반흔 물질(재료)이 형성되는 동안의 시간을 나타낸다.
최종 산물의 형성(고품질의 기능적 반흔)은 전체적인 수복 과정의 후기까지 완성되지 않는다. 일반적인 측면에서, 증식은 상해 후 1-2일에서부터 최대 2-3주까지 증가하며, 그 이후로는 상해 후 약 수 개월(전형적으로 4-6)까지 감소하는 것으로 생각된다.
2-4. 리모델링 단계 (REMODELLING PHASE) 리모델링 단계는 특히 치료 및 재활의 맥락에 있어서 중요성 측면에서 종종 간과되는 복원 단계이다.
이는 신속하거나 고도로 반응적이지 않지만, 복원되고 있는 조직의 모 조직에 유사한성격을 지닐 수 있는 잘 구성된 품질의 기능적 반흔을 형성한다.
리모델링 단계는 대략 증식단계의 최대 기간(상해 후 2-3주)과 거의 동일한 기간에서 시작하는 것으로 널리 받아들여지고 있지만, 좀 더 최근의 증거는 리모델링 단계가 실제적으로 이 보다 일찍 시작하며, 시작점이 첫 주로 간주하는 것이 합리적이다.
이러한 반응들의 결합의 최종 결과는 손상된 조직이 원래의 것으로 '끼리 끼리' 대체되어 복원되는 것은 아니지만, 상해로부터 품질 회복을 가능케 하는 기능적인 장기간의 해결책을 제공하는반흔으로 복원될 것이다.
대부분의 환자에서, 이는 약물, 치료 또는 기타 방도의 필요 없이 발생할 과정이다. 문제가 있거나 손상의 정도가 상당한 환자에서는 복원 과정을 용이하게 하기 위해일부 '도움'이 필요할 수 있다.
치료가 어떤 면에서 '필수적'인 것이라고 주장하기는 어려울 것이다.
신체는 이러한 상황들이 통제되는 복잡하고 균형된 기전을 갖는다.
그러나 억제된 반응, 지연된 반응 또는 반복되는 외상의 경우, 치료는 가치가 있다.
조직 복원의 과정을 변화시킬 필요가 있다는 점을 주장하는 것 또한 어려움이 있다.
조직 복원이개시되고 조절되는 효과적인(보통) 시스템이 있다면, 왜 이를 변경시킬 이유가 있는가? 좀 더 논리적인 접근은 조직 복원의 정상화를 용이하게 하거나 촉진하는 것이며, 그렇게 함으로써 상해된상태로부터 '정상' 상태로 조직을 얻는 반응들의 일련의 반응들을 강화시킨다.
이는 본 논문에서추후 언급될 것이다-개선된 정상화를 얻으려 하기 보다는 정상화의 촉진이 이 논문에서 논의될것이다.
이용 가능한 증거들도 또한 이러한 접근방식을 지지한다.
조직 복원 과정이 느리고, 정지되어 있거나 일부 지연되고 있다면, '정상적인' 추후 절차를 독려하는 것이 최선의 방법이다.
조직 반응을 개시하기 위해 '더 강하거나 더 집중적인' 요법을 요구할 수 있지만, 이는 '정상적으로' 진행 중인 복원 절차에 사용되는 것과 동일한 필수적인 기법들을 사용하여 달성된다.
임상적 치료에서, 조직 복원에 대한 우리의 관점은 관찰되는 환자에 의해 다소 왜곡된다. 정상적으로 조직이 복원되고 있는 대부분의 환자들은 좋은 결과를 얻기 위해 치료 도움을 요구하지 않는다.
병원을 찾은 환자의 대부분은 정상 복원 반응들이 방해 받거나 일어나지 않거나 어떤 식으로든 지연된 환자들이다.
그러므로 대부분의 '정상'근골격계 조직 복원은 많은 치료사에 의해 일 상적으로 경험되는 것은 아니다.
복원 반응을 통하여 치료가 효과적일 수 있는 기전은 일반적인 설명이긴 하지만 널리 알려지고있다.
이러한 효과는 반응을 "변화시키는 것" 보다 "촉진시킴으로써" 얻어지는 것으로 보여진다.
3. 염증 반응 (Inflammatory Events)
염증은 치유를 위해 정상적이고 필요한 전제조건이다(Aller et al, 2006; Hardy 1989; Serhanet al 2010, Medzhitov(2008)-통찰력있는 분석 제공).
손상의 특성, 물질의 수에 따라 정도가 다양하게 나타나는 조직 출혈 후에, 많은 수의 물질들이 후기 단계에 기여하는 조직에 남아 있게된다.
섬유소(피브린)과 피브로넥틴(fibronectin)은 다양한 세포의 접착을 돕는 토대를 형성한다.
염증 반응의 개시와 조절에 관여하는 화학적으로 매개되는 복잡한 증폭연쇄반응은 많은 반응에의해 시작될 수 있는데, 그 중의 하나가 외상이다.
기계적 자극, 열 또는 화학적 손상, 다양한 면역 반응은 또 다른 개시제가 될 수 있으며, 근골격계 조직에서 염증 반응을 경험한 많은 환자에서 이러한 원인들로 좀 더 쉽게 확인되고 있다.
비록 주요한 반응 및 조절 시스템이 기계적 자극등 다음으로 염증 반응에 관여하는게 맞다 하더라도, 본 리뷰의 목적에 맞춰, 오직 외상적 경로만 논의될 것이다.
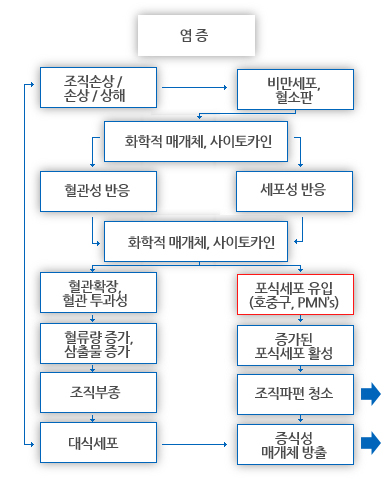
염증성 반응에 두 가지 필수적 요소가 있는데, 이는 혈관성 및 세포성 연쇄반응(cascades)이다.
중요하게도, 이들은 동시에 발생하고 유의하게 연결되어 있다. Figure 3는 염증성 연쇄반응의 필수 요소를 요약한 것이다.
이 과정에 활발하게 관여하는 화학적 매개체는 무수히 많다.
이것들은 Juminez 및 Jiminez(2004), Singer 및 Clark(1999)를 포함하여 많은 리뷰에서 유용하게 요약되어 있다.
이것들이 최신 리뷰는 아니지만, 그들은 주제에 유용한 배경지식을 제공한다.
Smith et al(2008)은 근육 상해와 연관된 매개체의 유용한 리뷰를 제공하며, Molloy et al(2003)는 인대와 건 상해와 관련하여 이러한 매개체의 역할을 리뷰하였다.
Rutkowski et al(2010)은성장과 재생과 관련한 보체 연쇄반응(cascade)의 역할을 리뷰하였다.
더 상세한 설명은 Serhanet al(2010)에서 찾아볼 수 있다.
최근에, 수많은 사이토카인과'성장인자'의 확인으로 여러 중요한 발견과 잠재적으로 새로운 치료라인으로 이어졌다(예, Wagner et al 2003; Leung et al 2006).
사이토카인 연쇄반응에서의 다양한 치료의 효과는 이 분야에서 많은 연구들이 진행됨과 함께 더욱 명확해지고 있다(본 논문의후반에서 추가적인 참고문헌 제공).
-
3-1. 혈관성 반응 (Vascular Events)
출혈과 관련된 혈관 변화에 추가하여, 혈관 자체의 상태에도 또한 명확한 변화가 있다.
혈관의 직경에서 변화, 혈관벽에서의 변화, 혈관을 통한 혈류에서의 변화가 있다.
혈관확장은 초기의 잠시 동안의 혈관수축 후에 나타나며, 염증 반응의 기간동안 지속된다.
주된 채널을 통해 혈류 흐름이 증가하며, 게다가 기존의 휴면 모세혈관이 모세혈관상을 통해 용량이 증가되도록 개방된다.
이 확장의 원인은 주로 화학적인 수단(히스타민, 프로스타글란딘, 보체 연쇄반응 요소 C3 및 C5, 기타 다수)에 의하며, 엑손 반사 및 자율신경계는 추가적 영향을 나타낸다.
혈류 속도에서의 초기 증가가 있으며 뒤이어 지속적인 더딘 흐름으로 이어진다. 백혈구는 가장자리에 위치하고, 혈소판은 혈관벽에 부착하고, 내피세포는 팽창된다.
혈관확장 반응에 추가하여, 국소 혈관의 혈관투과성에서의 증가가 발생하고(이 또한 수많은 화학적 매개체에 의해 중재됨), 혈관확장 및 혈관투과성 반응의 조합은 혈관을 통한 증가된 혈류가 좀 더 '누출'되도록 해주며, 삼출물의 증가로 이어진다.
혈관에서의 흐름과 압력 변화는 액체와 저 작은 용질이 조직 공간으로 통과하게 해준다.
증가된 정수압은 혈장 단백질의 삼투압을 극복하기에 충분하기 때문에, 이는 모세혈관망의 동맥 및 정맥 말단에서 모두 발생할 수 있다.
혈관은 혈장 단백질의 투과도에서 명확한 증가를 보인다.
투과도 변화에서 여러 단계가 있지만, 필수적으로 특히 세정맥에서 내피 세포의 분리와 간질 조직 공간으로의 단백질 풍부 혈장(PRP)의 증가된 누출이 있다.
투과도 변화에 관여하는 화학적 매개체는 프로스타글란딘으로부터 상승작용과 함께 히스타민, 세로티닌(5-HT), 브라디키닌, 류코트리엔이 포함된다.
삼출액(exudate)의 영향은 손상 부위에서 자극성 물질을 희석하며, 액체의 높은 피브리노겐 함량 덕택에 섬유소 응괴(fibrin clot)을 또한 형성하여, 주위 정상 조직 사이에 개시 연결을 제공하고 외부 입자와 파편을 붙잡을 수 있는 섬유주(meshwork)를 제공하여 준다.
섬유주는 또한 식작용에 도움을 주는 역할을 한다(아래 참조).
손상 부위에서 비만세포는 히알루론산 및 기타 프로테오글리칸을 방출하며, 이는 삼출액과 결합하여 국소 액체 흐름을 제한하는 겔(gel)을 만들고, 다양한 입자와 파편들을 추가적으로 붙잡는다.(Hardy 1989)
3-2. 세포성 반응(Cellular Events) 염증 반응의 세포성 요소는 혈관으로부터 식세포(호중구; 다형핵 백혈구 또는 PMN's)의 초기 이주(수분 내)를 포함한다.
이는 메인 흐름에서 단핵구, 림프구, 호산구, 호염구(Lorena et al 2002) 및 적은 수의 적혈구(백혈구의 활발한 이주 보다 수동적으로 혈관을 떠남)을 포함한 여러 종류의 세포들이 빠져나가게 된다.
조직 공간에서 단핵구는 대식세포가 된다(Forrest 1983; Hurst et al, 2001). 화학주성에 관여하는 화학적 매개체의 주된 그룹은 보체 캐스케이드(cascade)의 일부 요소, 림포카인, PMN's에서 방출되는 인자, 손상 조직 내 비만세포로부터 방출된 펩티드이다(Rankin, 2004; Egozi et al 2003; Luster, 1998; Vernon-Roberts 1988). Butterfield et al(2006)은 염증에서 호중구와 대식세포의 도움이 되는 영향과 잠재적으로 해로운 영향을 유용하게 고려하였다.
누출된 PMN은 상처의 초기 파편제거의 역할을 한다. 수많은 화학적 매개체들이 화학주성 역할을 갖는 것으로 확인되고 있으며, 예를 들면 손상된 혈소판으로부터 배출된 PDGF(혈소판 유래 성장인자)가 있다. 보체 케스케이드(C3a 및 C5a)의 요소, 류코트리엔스(다양한 백혈구, 대식세포, 비만세포로부터 배출), 림포카인(다형핵백혈구로부터 배출)들이 확인되고 있다(Walter and Israel 1987; Vernon-Robert 1988; Dierich et al 1987; Smith et al 2008 참조).
이러한 세포들은 강력한 식작용을 보이며, 필수적인 조직 파편제거 역할에 책임이 있다. 죽은 세포, 죽고있는 세포, 섬유소 메쉬(fibrin mesh) 및 남아있는 응괴(clot)은 모두 제거될 필요가 있다.
'보너스'로서, 식세포작용의 최종산물로써 배출된 화학물질 중 하나는 수복 과정 중에서 다음 반응인 증식의 자극제 중 하나인 젖산(lactic acid)이다.
그러므로 염증 반응은 결과적인 부종과 식작용 활성화와 함께 혈관 반응, 세포성 및 액체 삼출물로 이어진다.
화학적 매개체의 복잡한 상호작용은 염증 단계의 다양한 요소들을 자극할 뿐만 아니라, 증식 단계를 자극한다.
염증 반응의 코스는 파괴된 세포의 수, 과정의 본래 원인, 손상 시 조직 상태에 따라 달라질 것이다.
-
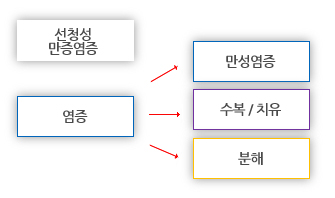
분해(Resolution)는 임계 수 이하의 세포가 파괴된 조건에서의 가능한 결과이다. 우리가 관찰한 대부분의 환자에서, 명백한 손상 보다 조직 자극이 개시제가 아닌 한 시나리오가 될 것 같지 않다.
'미세 상해' 또는 '미세 외상' 관련하여, 또한 수복 반응 또는 분해로 이어질지 아닐지에 대하여 일부 많은 논란이 있다.
미세 수복이 되어야 하는 것이 가능하며, 만약 조직이 이러한 방식으로 반응하는데 실패한다면, 미세손상된 조직은 수복 반응을 시작하는데 실패하며, 따라서 축적된 손상이 되어 잠재적으로 장기간 이슈가 된다.
이 논란은 흥미로운 증거들과 함께 계속되고 있다(예, Lin et al, 2004; Rompe et al, 2008; Frick and Murthy, 2010; Taljanovic et al, 2011).
감염성 미생물의 존재하는 곳에서는 화농(Suppuration)은 농(pus)이 형성된다.
농은 죽은 세포파편, 염증성 삼출액에 부유하는 살아있거나 죽거나 죽어가는 다형핵백혈구로 구성된다.
감염이 있다면 명확하게 창상의 치유를 지연될 것이다(Zederfelt 1979). 일부 임상 시험에서, 조직내 감염은 주요한 이슈이다.
이의 중요성을 무시하지 하는 것은 아니지만 본문에서는 추가로 고려되지 않을 것이다.
만성염증(Chronic inflammation)은 장기간의 염증을 의미하는 것은 아니며, 일시적 또는 지연된 급성 염증 단계 후에 올 수 있다(Vernon-Roberts 1988).
기본적으로 만성 염증에는 2가지 형태가 있다: 만성 반응은 급성 반응에서 발생되거나 초기 급성 단계 없이 천천히 발달할수 있다(처음부터)(Hurley 1985).
처음부터 발생하는 만성 염증은 국소 자극제, 불량한 순환,일부 미생물 또는 면역 장애를 포함하여 많은 원인이 있을 수 있다.
만성 염증은 보통 삼출성보다 생산성이다- 이는 염증성삼출물보다 섬유성 물질을 좀 더 많이 생산한다.
빈번하게 일부조직 파괴, 염증, 동시에 발생하는 미완료된 치유가 있다(Serhan et al, 2010; Metz et al,2007; Hurly, 1985; Walters and Israel 1987).
섬유화에 의한 치유/복원(Healing/Repair by firbrosis)는 여기에서 고려되는 조직 복원 시니리오에서 좀 더 일어날 확률이 있다. 염증 단계로부터 섬유소 침착은 섬유소용해 효소(혈장 및PMN's로부터)에 의해 일부 제거될 것이며, 반흔 조직을 형성하도록 조직화되는 육아조직에의해 점차적으로 대체될 것이다.
대식세포는 크게 섬유소의 제거에 책임이 있으며, 모세혈관버딩(capillary budding)과 섬유아세포 활성을 진행시키게 한다(증식). 손상 조직의 양이 많으면 많을수록, 반흔 조직의 양과 밀도는 커진다.
만성 염증은 유의한 조직 파괴가 없는 상태에서도 일부 섬유화를 동반한다(예, Hurley 1985; Li et al, 2007).
급성 염증의 영향은 대체적으로 유익하다. 액체성삼출물은 독소를 희석하고, 누출된 혈액 산물은 항체(및 전신 약물)를 포함한다. 피브리노겐은 미생물의 전파(존재 시)에 대해 기계적 장벽을 제공하는 섬유소 응괴를 형성하며, 추가적으로 식세포작용을 돕는다. 염증성 삼출물의 젤과 같은 농도는 또한 주위 정상 조직에 염증성 매개체의 전파를 막음으로써 긍정적인 역할을 한다.
침입하는 세균(존재 시)의 림프계의 이동은 면역 반응을 자극하는 한편, 증가된 혈류는국소 산소량, 필요 영양분의 공급, 폐기산물의 제거를 증가시킴으로써 증식 단계에서 필요한세포 대사를 증가시키는데 기여한다.
백혈구는 외래 물질, 세균, 죽은 세포의 식작용에 대한기전을 제공하며, 호중구(PMN's)와 단핵구(대식세포가 됨)가 가장 큰 기여를 한다.염증에는 여러 해로운 측면들이 있다.
첫째로, 부종으로부터 증가된 국소 정수압은 만약 상해조직 공간이 제한적이라면 혈류 흐름을 제한할 수 있고, 통증을 유발하고, 기능을 제한하고,게다가 국소 산소 수준을 줄인다.
급성 염증 반응의 결과로써 생산된 자유 라디칼은 PMN 활성으로부터 리소솜 효소의 과 생산에 따라 세포막 과정에서 유해한 영향을 받는다는 주장들이 있다.
기계적에서 생화학적까지 치료적 개입에 의해 영향을 받을 수 있는 염증 반응의 많은 측면들이존재한다. 화학적 매개체, 사이토카인, 성장인자의 '수프'에서 수동 운동 치료의 효과를 지지하는 많은 체내 증거들이 있다.
다한 치료 양식들이 적절한 용량으로 적용될 때, 영향을 발휘할 수도 있다(수 백개의 논문들이 있다- 이는 일부 선택한 것이다).
1. Caltrioni et al (2008) – 운동과 혈장 글리코사미노글리칸 수치 사이의 관계
2. Fujiwara et al (2005) – 기계적 부하와 bEGF
3. Handschinand Spiegelman (2008) - 운동과 PGC1a
4. Kahn and Scott (2009) – 기계적 부하와 IGF
5. Kido et al (2009) –기계적 부하와 IL-11 발현
6. Li et al (2004) 기계적 스트레칭과 섬유아세포 습성
7. Ostrowski et al (2000) – 운동과 인터루킨-6(IL-6) 생산 사이의 관계
8. Takao et al (2011) –기계적 부하와 COX-2, interleukin-1β, PGE2
1. Khanna et al (2009) - LIPUS 및 다양한 사이토카인 작용 검토
2. Leung et al (2006) – 무릎 인대 치유에서 초음파 및 TGF-β
3. Li et al (2003) – LIPUS 및 다양한 사이토카인 (TNF-α 및 TGF-β1 및 IL-6)
4. McBrier et al (2007) – US 및 기계적 성장인자 (MGF)
5. Nussbaum and Locke (2007) - US 및 열 쇼크 단백질
6. Rego et al (2010) - US 및 PGE2 합성
7. Sugita et al (2008) - US 및 질산(NO)
1. Bjordal et al (2006) –레이저 치료와 조직 내 변화된 프로스타글란딘 수치(아킬레스 건)
2. Mesquita Ferrari et al (2011) –레이저 치료, TNF-α 및 TGF-β
3. Safavi et al (2008) –레이저 및 다양한 염증성사이토카인
4. Sawasaki et al (2009) –레이저 및 비만세포 탈과립
5. Saygun et al (2008) – 레이저 치료 및 bFGF및 IGF-1
1. Zhang et al (2004) – 전기침술과 말초 염증성 반응 사이의 관계 증명>
2. Sakurai et al (2008) –자기장 및 프로스타글란딘 E2 분비
이 같은 측면에서 '전형적인' 양식에 추가하여, 영향을 미칠수 있는 작은(내재성) 전류가 남아 있을 가능성이 있음이 알려져 있다(Watson, 2008). 미세전류 기반 치료의 적용은 염증/복원 결과의 본 요소를 강화시키는 것으로 생각되며 (Poltawski 및 Watson, 2009), 대부분의 전기 자극 양식은 조직 복원 결과에 직접적인 영향을 받지 못하는 한편,
증식 반응(Proliferative Events)
-
복원 과정은 수복(반흔) 조직의 침착에 의해 조직 연속성을 회복시킨다.
이는 반흔 조직을 형성하기 위한 성숙한 초기 육아 조직이다. 수복 조직은 장소에 고유한 결합조직으로부터 여러가지 방법으로의 개시와 다른 결합조직이다(Forrest 1983).
흥미로운 최근 연구는 기계수용 성장인자의 활성화와 근육 위성(줄기) 세포의 차후 활성과 관련되어, 근육에서 외상 후 재생 활성 정도가 있음을 확인하였다(Hill et al 2003).
다양한 성장인자는 증식 과정에서 활발해지는 것으로써 확인되고 있으며, 이는 다시 새로운 치료 가능성으로 이어진다(Hildebrand et al 1998). 이러한 사이토카인의 대부분의 기원은 염증 단계이며, 그러므로 "잠금(turning off)" 또는 염증 반응을 제한시키는 것은 이러한 증식 반응을 자극하는 신호 강도를 줄이게 된다(Boursinos et al, 2009; Beck et al, 2005; Dimmen et al, 2009; Radi et al, 2005).
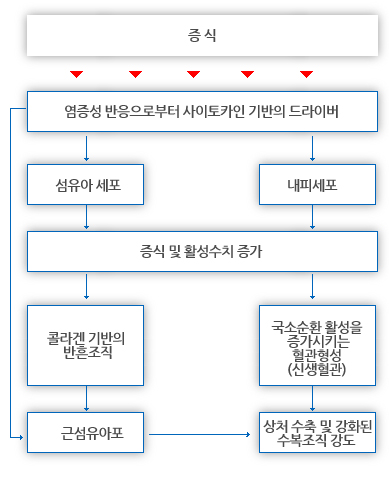
수복과 관련된 두가지 근본적인 과정은 섬유증식증(fibroplasia)와 혈관형성(angiogenesis)이다.
섬유증식증의 기능은 결합조직을 수복하기 위함이다(Vanable 1989).
섬유증식증은 주위 조직으로부터 상처부위로 이주하는 것으로 보여진다.
섬유아세포 활성화는 특히 염증 단계 동안 대식세포로부터 배출된 화학물질에 의해, 화학적으로 중재되는 것으로 보여진다.
섬유아세포는 손상 부위 내로 이주하며, 조직 손상 후 수일 내에 증식한다. 대식세포 유래 성장인자(MGDF's)는 섬유아세포 활성화에 최소 부분적으로 관여하는 매개체의 복합체 집단이다.
섬유아세포 활성화와 동시에, 조직 손상 부위의 모세혈관이 형성되고 수복 부근을 향해 자란다.
부위를 통해 혈류 흐름이 재확립되어 문합과 동시에 루프(loops)와 아케이드(arcades)가 형성되며, 이는 대사 및 수복 폐기산물을 제거하는 동시에 산소와 영양분을 제공한다.
산소는 많은 회복 과정에 중요하지만, 특히 콜라겐 합성에 중요하다(Vanables 1989. Niinikoski 1980). 다양한 성장인자와 화학적 매개체는 발달 중인 모세혈관에 영향을 주는 것이 확인되었다.
이들은 대식세포 유래 인자, PDGF, 젖산, 섬유아세포 성장인자를 포함한다(Vernon-Roberts 1988). 이러한 매개체 중 일부는 염증 단계 동안 생산되며, 염증 및 증식 단계 사이 필수적인 관계를 이어준다.
다양한 치료가 이러한 증식 및 혈관형성 반응에 (긍정적으로) 영향을 줄 수 있다는 증거들이 증가하고 있다. 다양한 치료는 다음을 포함한다.
▷ Azuma et al (2001)는 LIPU가 골절 치유에 관한 혈관형성에 영향을 준다고 증명하였다.
▷ Reher et al (2002)는 NO와 PGE2 생산과 관련하여 초음파의 영향을 증명하였다.
▷ Zhao et al (2004)는 VEGF 매개된 반응에 의해 전기 자극 및 혈관형성 증대 사이의 관계를
▷ 증명하였다.
▷ Fitzsimmons et al (2008)는 펄스 전기장, 연골세포 활성, 산화질소 경로 사이의 관계를 증명하였다.
▷ Chao et al (2008)는 쇼크웨이브 치료, TGF 베타, 산화질소 경로 사이의 관계를 증명하였다.
▷ Rego et al (2010) 프로스타글란딘(PGE2) 합성의 초음파 자극
▷ Cheung et al (2011) 골다공성 골절에서 초음파(LIPUS) 및 혈관형성
▷ Kuo et al (2009) 쇼크웨이프 치료는 창상 치유 모델에서 VEGF를 포함하여 여러 사이토카인을 증가시킨다.
▷ Bossini et al (2009)는 창상 수복에서의 혈관형성 반응에서 레이저 치료의 영향을 증명하였다.
▷ Lu et al (2008) 골절 치유에서 초음파(LIPUS) 및 VEGF 조절
육아조직 침습은 '파괴' 단계가 뒤따른다(자가분해 효소가 PMN's 및 죽은 세포로부터 배출되었을 때)(Walter and Israel 1987). 섬유아세포의 활성화와 모세혈관 버딩(budding)은 조직 손상 후 약 3일째까지 보통 발생한다.
모세혈관 버딩과 콜라겐 합성의 조합은 보통 수복 부위보다 좀 많은 혈관으로 이어진다.
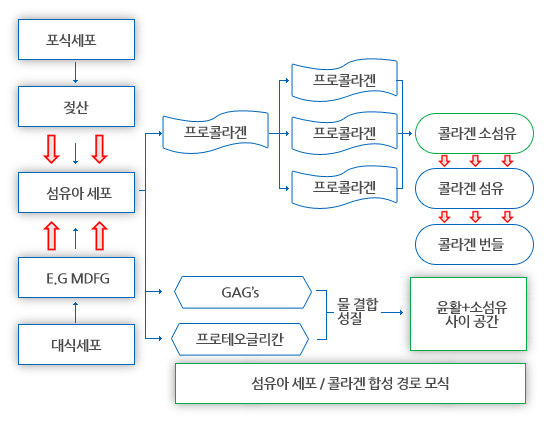
섬유아세포는 초기에 타입 III 콜라겐을 우세하게 생산하며, 이는 수복이 성숙함(리모델링)에 따라 타입 I 콜라겐으로 될 것이다(Walter and Israel 1987). 섬유아세포는 또한 기질의 필수 성분인 피브로넥틴과 프로테오글리칸을 형성한다(Figure 5)(Walter and Israel 1987, Forrest 1983, Hardy 1989).
근섬유아세포는 다양한 화학적 매개체에 의해 활성된 섬유아세포로부터 유래되며, 창상 수축 및 수복의 초기 강도에 관여한다.
이들은 창상 모서리를 끌어당겨서, 최종 반흔의 크기를 줄여준다(Gabbiani 2003; Lorena et al 2002; Peacock 1984; Hardy 1989; Wipff et al, 2009; McAnulty, 2007).
육아조직은 림프계 발달(모세혈관 발달과 같은 방식으로), 신경 섬유 증식, 비만세포 침윤으로 성숙한다.
콜라겐 섬유는 국소 부하(스트레스)에 반응하여 지향하게 되고, 따라서 필요한 방향에서 인장 강도를 제공해준다(유용한 콜라겐 리뷰를 위해 Forrest 1983 및 Hardy 1989 참조).
육아조직이 성숙함에 따라, 혈관의 공간이 소멸되며 혈류차단의 과정이 있다,
-
근섬유아세포는 다양한 화학적 매개체에 의해 활성된 섬유아세포로부터 유래되며, 창상 수축 및 수복의 초기 강도에 관여한다. 이들은 창상 모서리를 끌어당겨서, 최종 반흔의 크기를 줄여준다(Gabbiani 2003; Lorena et al 2002; Peacock 1984; Hardy 1989; Wipff et al, 2009; McAnulty, 2007).
육아조직은 림프계 발달(모세혈관 발달과 같은 방식으로), 신경 섬유 증식, 비만세포 침윤으로 성숙한다.
콜라겐 섬유는 국소 부하(스트레스)에 반응하여 지향하게 되고, 따라서 필요한 방향에서 인장 강도를 제공해준다(유용한 콜라겐 리뷰를 위해 Forrest 1983 및 Hardy 1989 참조). 육아조직이 성숙함에 따라, 혈관의 공간이 소멸되며 혈류차단의 과정이 있다
공동현상은 초음파 에너지에 의해 형성된 가장 큰 비-열 효과이다(Doktycz and Suslick 1990; Prozorov et al., 2004). 공동현상은 생물학적 조직에 변화를 야기하는, 특히 막 투과성 증가, 주된 기전으로 고려된다(sivakumar et al., 2005). 공동현상의 2가지 다른 타입이 있다: 안정적 공동현상과 일시적 공동현상.
전자는 거품(버블)을 생산하고, 이는 수많은 음향 주기에 대해 존재하고, 모든 거품(버블)의 반경은 평형 값에 대해 다양하다. 후자는 그들의 평형에 대해 불안정한 방식으로 진동하는 거품(버블)을 형성하며, 단일 압축 반주기 동안 맹렬하게 붕괴하기 전에, 2-3배 공명 크기로 확대된다(Feril and Kondo 2004). 일시적 공동현상 작용은 정상 세포 손상의 주된 기전으로 여겨진다.
초음파는 많은 단계와 균질계에서 물질 전달과 반응률을 촉발시키는 액체 매질의 운동을 강화한다(Bar, 1988).
경계층, 막 및/또는 세포벽, 세포질은 이 과정이 발생하는 3가지 영역이다. 진동의 가스 거품(버블)이 음향 장 순환 액체 운동 주위에서 형성된다고 받아들여지고 있으며, 마이크로유동(microstreaming)이라고 일컫어진다.
이 사실은 효소의 활성 부위 또는 세포로 시약의 흐름과 매질로 반응 산물의 흐름을 야기하고, 결국 회전률 양을 증가시킨다.
리모델링 반응(Remodelling Events)
-
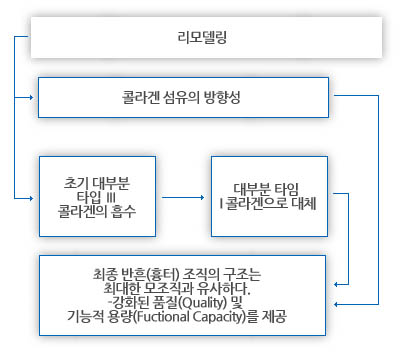
리모델링 단계는 주로 콜라겐과 그와 연관된 세포외기질의 개선을 수반한다.
콜라겐의 초기 침착은 무작위 방향의 상대적으로 약한 소섬유(피브릴)를 생산한다.
성숙함에 따라, 콜라겐은 좀 더 국소 부하와 일치한 방향이 된다.
(Culav et al 1999, Gomez et al 1991).
원래의 미세한 (타입 III) 콜라겐 부분은 재흡수되고(교원효소-콜라게나제-의 작용에 의해), 좀 더 교차 결합되고 인장 강도가 높은 타입 I 콜라겐으로 대체된다(Vanables 1989, Forrest 1983).
콜라겐 합성 및 용해는 이전의 섬유 조직이 제거되고 새로운 반흔 조직이 축적됨에 따라, 비창상 조직과 비교하여 정상 창상에서 좀 더 높은 비율로 발생한다.
그러므로 반흔 성숙은 정적인 시스템 보다 동적인 시스템이다.
물리적 부하(스트레스)를 포함하여, 이러한 장기간 단계 동안 여러 영향력이 있는 인자들이 존재한다.
이 리모델링 과정은 증식 단계가 진행되는 동안에 개시되며, 따라서 단계 사이에 상당한 오버랩(겹침)이 존재한다.
최종 리모델링은 수개월 간, 보통 초기 손상으로부터 최소 몇 년간 지속될 것이다.
리모델링에서 콜라겐 습성(behavior)의 종합적인 고려사항에 대해서 Hardy(1989)를, 콜라겐과 그 역할의 훌륭한 리뷰에 대해서는 Culav et al(1999)를 참조한다.
물리적 부하(스트레스)가 세포와 조직 습성(behavior)에 영향을 주는 가능한 기전은 Ingber(2003, 2008)에 의해 유용하게 정리되었다.
Bring et al(2007)과 Cyr and Ross(1998)과 함께 Kahn 및 Scott(2009) 및 Killian et al(2012)는 기계적 부하(스트레스)와 조직 수복을 관련하여 좀 더 최근 논문을 제공하고 있으며, Mackey et al(2008)은 또한 가치있는 리뷰를 제공하고 있다.
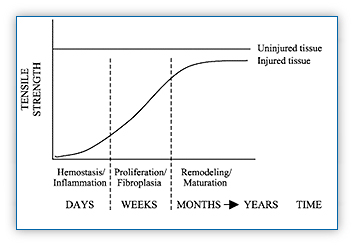
인상깊게도, Figure 8에서 인용된 것처럼, 최종 수복의 강도는 상해전 강도와 일치하지 않을 것이라고 주장되고 있다(after Lin et al, 2004).
-
치유를 지연시키는 것으로 알려진 인자는 일반적 사항과 국소적 사항으로 나눠진다.
일반적 사항: 나이, 단백질 결핍, 낮은 비타민 C 수치, 스테로이드 & NSAID's(억제성 효과), 온도(추울 때 더 느린 속도) 국소: 불량한 혈액 공급/허열, 뼈 또는 기타 내재 조직으로의 부착, 지연된 염증, 창상의 건조, 과도한 이동 또는 물리적 부하(스트레스)(염증 재시작)
치료 영향(THERAPY INFLUENCES
다양한 치료의 전체 영향은 여기에서 세세하게 고려될 수 없지만, 근본적으로 복원 반응에 도움이 되는 치료는 자연 결과를 변경하는 것 보다는 자극하는 치료이다.
염증 반응을 촉진하거나 자극하는 것은 '더 큰' 염증 반응을 얻기 위함이 아니라 그 효율을 극대화하기 위함이다.
유사하게도, 증식 단계 동안 치료가 전달된다면, 단지 반흔 조직의 양을 더 크게 만드는 것에는 이득이없다.
적절한 개입의 장점은 효과적인 반응을 최대로 자극하여 필요한 복원 물질이 최적의 품질과 최소한의 시간으로 형성되는 것이다. 리모델링 단계에서, 반흔 조직의 개선이 목적이고, 치료의 이용이 유의한 효과를 가질 수 있으며, 기계적 부하(스트레스)와 콜라겐 습성(behavior)의 영향과 관련된 체내 증거들이 많이 제시되고 있다.
어느 단계에서 부적절한 치료는 이러한 반응들을 억제할 수 있고, 그러므로 어설픈 복원으로 이어지게 된다 – 치료가 항상 유익하다고 보장되지 않는다.
필요한 반응들을 유념해야 하고, 각 단계에서 가장 적절한(증거가 있는) 치료를 선택해야 한다.
최근 다른 흥미로운 발견은 기존 치료가 복원 중인 조직의 화학적 환경에 영향을 미친다는 생각을 지지하는 체내 지식들이 증가하고 있는 점이다(Watson, 2011). 운동 치료, 수동(매뉴얼) 치료,전기치료에서의 다양한 양식은 이러한 효과를 발휘하는 것으로 알려져 있다 – 일부는 본 논문에서 이미 제공되었다.
이는 치료의 작용 모드에 대해 최근의 설명을 대체하지 않고, 기계적, 신경학적, 전반적인 생리학적, 화학적, 생체전기 치료 효과가 있는 확장된 효과 모델을 제공한다.
기존에 사용되었던 이러한 치료의 작용 모드는 원래 받아들여지고 지금까지 이해되어 온 것보다실제로 훨씬 복잡하다.
결론(Conclusion)
조직 치유는 손상된 조직의 효과적인 수복을 가능케하는 복잡하고 동적인 시스템이다.
수복 조절 시스템 및 그것의 다양한 성분 사이의 관계는 복잡하며, 많은 양의 문헌이 있고, 지금도 새로운 매개체, 사이토카인, 이형을 밝히고 있다.
이러한 지식 기반이 확대되고 있으며, 또한 치료의 효과와 이러한 화학적 조절 시스템 사이의 관계도 성장하고 있다.
적절한 치료는 치유 과정에 긍정적인 방법으로 영향을 줄 수 있는 능력을 갖추며, 가장 논리적이고 가장 증거 중심의 중개 접근은 새로운 뭔가로 치유 반응을 바꾸려 시도하는 것 보다는 오히려 '정상' 반응을 활발하게 하거나 촉진하는 것임에는 의심의 여지가 거의 없다.
만약 수복이 진행 중 이라면, 계속 이동하게 한다.
만약 지연되고 있다면, 정상 궤도에 오르게 돕기 위해 활발하게 한다. 무수히 많은 접근 방식이 있지만, 가장 효과적인 것은 본 논문을 따르는 것으로 보인다.


